
一種罕見病:肝豆狀核(hé)變性(xìng)及其動(dòng)物(wù)模型
最近驚聞一位朋友因患一種名為肝豆狀核變性的罕(hǎn)見病(bìng)而離世,突感罕(hǎn)見病並不罕見,它往往就(jiù)在我們身(shēn)邊。因筆者對肝豆狀核變性研究有所(suǒ)涉獵,本(běn)文將對該病及其動(dòng)物模型作簡要介紹。
01、首(shǒu)次(cì)發現及致病機製
肝豆狀核變性又(yòu)名Wilson病(Wilson’s disease,WD) ,1912年首次由Samuel Kinnear Wilson博士描述。該病表現為“漸進性豆狀核退化”,在患者(zhě)的肝髒和大腦等器官中發現了過量的銅,該病在全球的患(huàn)病率約為1/30000。經過多年(nián)研究(jiū),肝豆狀核變性(WD)的發病機製已經研究的較為清楚,它(tā)是一種常染色體隱性遺傳銅代謝障礙疾病[1]。1993年三個獨立研究(jiū)小組幾乎(hū)同時發現了ATP7B基因(yīn)為Wilson病的致病基因。該(gāi)基因編碼銅轉運P型 ATP酶 ( copper-transporting P-type ATPase,ATP7B)[2],WD患者攜帶發生突變的ATP7B基因,血(xuè)清銅藍蛋白合成(chéng)及正常的銅(tóng)代(dài)謝過程發生(shēng)障(zhàng)礙,過量的銅沉(chén)積在組織器官中,如肝髒、大腦、腎(shèn)髒、角膜中,其中最常受累的是肝髒和神(shén)經係統[3]。
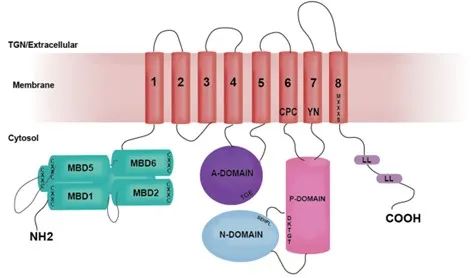
圖1.ATP7B蛋白(bái)結構圖
圖注:N-端包含六個結合銅的金屬結合結構域(MBD1-MBD6,青色);參與Cu配位的殘基在膜內的位置為CPC、YN和(hé)MXXXS;位於C末端的兩個亮氨(ān)酸(suān)基序(1459LL和1487LL)對胞吞作用和TGN從質膜重新定位至關重要[4]。
02、臨床(chuáng)表現及(jí)診斷
WD患者在臨床表現(xiàn)上包括嚴重程度不等的肝損傷、持續性(xìng)血清轉氨酶升高、急性或慢性肝炎、代償期(qī)或失代償期肝硬化和暴發性肝功能衰竭等[5]。神經係統的(de)表現以(yǐ)椎體外係病變症狀為主,包括僵硬(yìng)、震(zhèn)顫、運動遲緩、構音障礙(ài)、吞咽障礙、舞蹈症狀、癲癇發作等,精神症狀包括躁(zào)狂、性格改變、抑鬱等[6, 7]。此外腎髒、血液(yè)係統及骨關節等器官(guān)係統(tǒng),也會出現相應的(de)臨床症狀和體(tǐ)征。
患(huàn)者出現以下一些症狀或指標可供臨床診斷:
1. 角膜K-F環是某些WD患者一個比較明顯的特征。K-F環為角膜邊緣的黃綠色或黃(huáng)灰(huī)色色素環,一般在手電筒側光照射下肉眼可見,7歲以(yǐ)下患者一般無(wú)法檢(jiǎn)出角膜K-F環。
2. 肝(gān)脾檢查:肝功能(néng)血清轉氨酶(méi)、膽紅素升高和(或)白蛋(dàn)白降低;肝脾B超:常顯示肝實質光點增粗、回聲增強甚至結節狀(zhuàng)改變(biàn);部分(fèn)患(huàn)者脾髒腫(zhǒng)大;肝髒MRI檢查常顯示肝脂質沉積(jī)、不規則結節及肝葉萎縮等。
3. 采用銅代謝相關生化檢查,銅藍蛋白<120mg/L,24小時尿銅≥100μg。
4. 顱(lú)腦MRI檢(jiǎn)查主要表現為殼核、尾狀核頭部、丘腦、中腦(nǎo)、腦橋及小腦T1低(dī)信號(hào)、T2高信號,少數情況下可出(chū)現T1高信號或T1、T2均低信號。
5. 基因篩(shāi)查:對於臨床證據不(bú)足但又高度(dù)懷疑WD的(de)患者,篩查ATP7B基因致病變異對診斷具有指導意(yì)義。
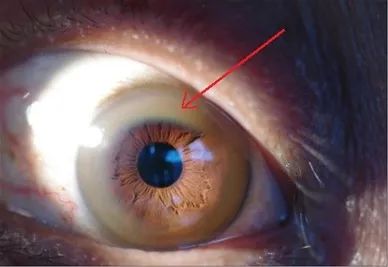
圖2. 角膜邊緣黃色渾濁(zhuó)的K-F環
03、ATP7B突變類型及地理分布
ATP7B基因突變在不同種族和地域中存在遺傳異質(zhì)性(xìng)。歐洲人(rén)群最常見的突(tū)變類(lèi)型是14號外顯子(zǐ)上的 H1069Q突變,在意大利、瑞典和羅馬尼亞等地多見,臨床主要以錐體外係症狀為主(zhǔ),如震顫、肌張力障礙、精神症狀等(děng)。亞洲人群最常(cháng)見的突變類型是 8號外(wài)顯子(zǐ)上的錯義突變R778L,以中國、韓國和(hé)日本最多見,臨床以肝髒方麵症(zhèng)狀為主,如肝功能異常、肝硬化、肝脾大等;其餘常見的還有 P992L、Q1399R等(děng)[8]。
04、肝豆(dòu)狀核變性動物模型
1. “毒乳”( toxic milk,TX)小鼠
肝豆狀核變性(xìng)動物模型中最有名的是一種“毒乳”( toxic milk,TX)TX小鼠。 “毒乳”小鼠(shǔ)這一名稱源自雌性純合子TX小鼠乳汁中缺乏銅,因此其(qí)哺乳的幼(yòu)鼠在2周(zhōu)左右時會由於銅缺乏而死亡。後續研(yán)究證(zhèng)明“毒乳”為(wéi)ATP7B基因突變(biàn)小鼠。
TX小鼠又分為兩種,一種是1974年由Harold Rauch在DL近(jìn)交係小鼠F68代中發現的自(zì)然突變,後(hòu)來(1996年)被鑒定為ATP7B基因外顯子20中4066位(wèi)的A到G堿基變化,導致第八跨膜區(qū)M1356V(甲硫氨酸to纈氨酸)的改變。TX鼠於第3周開始出現銅在髒器的沉積,首先是肝髒和腦,以肝髒為重,至第4個月銅沉積最為顯著,可(kě)達對照(zhào)組(zǔ)的60~80倍。同期(qī)腎髒亦有大量沉積。這種由肝至腦再到腎的銅沉積過程(chéng)與WD患者的一般臨床病程相似[9]。
另(lìng)一種TX小鼠是1987年在傑克遜實驗室的C3H/HeJ群體中出現的自然突變品係TX-J小鼠,現對外出售,編號001576。該(gāi)突變小鼠是ATP7B基因(yīn)外顯子8中2135位的G到A的堿(jiǎn)基突變(biàn)。與TX小鼠相似,TX-J小鼠與WD患者以相似的方式在肝髒中(zhōng)積累銅,成年純合子TX-J小鼠會發展(zhǎn)為(wéi)肝硬化。
TX和TX-J小鼠不能完全模(mó)擬WD患者,其角膜無K-F環;與WD患者的肝髒損傷也有顯著差異;且(qiě)沒有關(guān)於人類WD母親的嬰兒銅缺乏現象的報告;另外TX小鼠缺乏明顯(xiǎn)神經係(xì)統症狀,TX-J小鼠也(yě)隻有輕微的行為異常(cháng)。但TX和TX-J小(xiǎo)鼠ATP7B mRNA的轉錄水平沒有(yǒu)明顯改變且ATP7B基因功能部分保留,並具(jù)有與WD患者相類似(sì)的病理過程和銅生化特征,同時也由於其容易獲得,是目前使用最多的WD動物模(mó)型之一,廣泛應用於一些治(zhì)療藥物的試(shì)驗(yàn)。
2. ATP7B基(jī)因修飾小鼠(shǔ)
利用同源重組技術或CRISPR基(jī)因編輯技術敲除ATP7B基因第2外顯子獲得的ATP7B-/-基因敲除小鼠也越來越多(duō)的(de)被用於WD研究(jiū)。ATP7B-/-基因敲除小鼠具有與人類WD和TX小(xiǎo)鼠相似的銅沉積(jī)表型,但(dàn)與TX鼠模型相(xiàng)比發病較早且肝損傷更嚴重,肝炎、壞死性炎症、膽管增殖、纖維化,甚至後續的腫瘤發生等症狀都比TX鼠更接近(jìn)人類WD的(de)肝髒病理結果。
隨著基因編輯技術的進展,采用基因編輯工具CRISPR/Cas9+ssDNA[10],或(huò)采用堿基編輯(Base Editor)、先導編輯(Primer editor)技術,結合胚胎操作術可以較輕鬆地在小鼠ATP7B基因上構建與人類WD同源的突變位點。理論上可以獲得更接近人類WD特征的小鼠模(mó)型(xíng)。
3. LEC(Long–Evans Cinnamon)大鼠
LEC大鼠是一種近交係突變大鼠,最初是從Long–Evans大鼠群體中(zhōng)分離出來的,它的ATP7B基因在3’端編碼區缺失了900個堿基,以及下遊未翻譯區缺(quē)失了約400個堿基。LEC大鼠(shǔ)主要(yào)表現出(chū)自發性肝銅異常(cháng)積聚伴隨低血清銅和低銅(tóng)藍(lán)蛋白,大約4月齡時出(chū)現暴發(fā)性肝炎或暴發性肝衰竭、轉氨(ān)酶和膽紅素(sù)升高,部分或大量肝細(xì)胞壞死,病死率至少30%~40%,存(cún)活下來的(de)大鼠多在12月齡時發生肝纖維化並伴有肝細胞癌和膽管癌。由於肝病進展迅速,LEC大鼠特別適合幹預治療研究,如各種排銅絡合劑和(hé)幹細(xì)胞治療研究等。

圖3. LEC(Long–Evans Cinnamon)大鼠
4. 其他大型哺乳動物模型(xíng)
一些大型哺乳動物在銅代(dài)謝方麵也存(cún)在遺傳(chuán)缺陷,均表現出(chū)銅在肝髒中積累和銅毒性,例(lì)如犬(杜賓犬、拉布拉多尋回犬、貝靈頓梗犬(quǎn)Bedlington Terrier)和北羅納德賽羊等。然而這些大型哺乳動物銅代謝方麵的遺傳缺陷與人類WD並不相同,如貝靈頓梗犬(quǎn),導致其肝銅積(jī)累的遺傳缺陷是由(yóu)於COMMD1(MURR1)基因39.7kb的刪除,而非ATP7B基(jī)因,故作為(wéi)人類WD模型的作用有其局限性[11, 12]。若能在大型哺乳動物甚至非人靈長(zhǎng)類動物的ATP7B基因(yīn)中引入突變,或將造就更好模擬人類WD的動物模型。
05、肝豆狀核變性的(de)治(zhì)療
在目前的治療方案中(zhōng),WD患者需進行終(zhōng)生治療,主要目標為治療銅過載。基(jī)本原則包括低銅飲食:避免或限製富含(hán)銅的食物,如肝髒(zāng)、水生貝殼類動物、堅果、巧克力、豆類、蘑菇等。藥物治療方麵以青黴胺、曲恩汀為代表的金(jīn)屬絡合劑增加銅的排除,以鋅劑為代(dài)表的藥物減少銅的吸收。治療越早越好,患者通常不能停藥,因為治療中斷(duàn)很可能導致失代(dài)償性肝損傷及神經不可逆損傷。
值得注意的是WD的藥(yào)物治療有一定的局限性,除需(xū)要終生治療外,約(yuē)1/3 WD患者用藥期間會出現與藥物相關的不良事件,導致不(bú)得不更換藥物(wù),甚至可能導致治療失敗(bài),WD晚期導致的肝衰竭或失代(dài)償期肝硬化(huà)需要進行肝移植(zhí),這可能(néng)是最(zuì)後的常規(guī)治療手段。
鑒於WD是非常明確的由ATP7B基因突變所致的疾病,因此基因治療或許有廣闊的(de)前景。目前已有基於動物模型的WD基因治(zhì)療研究。如Murillo等(děng)在研究中(zhōng)用編碼人ATP7B cDNA的AAV8載體轉導到ATP7B-/-小鼠(shǔ)模型的肝髒,發現治療後血清轉氨酶降低,尿銅排泄量減少,血清全血漿蛋白(bái)的正常化(huà)[13]。此(cǐ)外,2019年Liu等通過CRISPR/Cas9替換了小鼠模型中ATP7B基因的第8外顯子[14];2020年(nián)Michael等使用CRISPR/Cas9+ssODN的方法糾正人類細胞(bāo)係中的ATP7B點突變[15]。筆者嚐試用一種(zhǒng)ABE堿(jiǎn)基編輯器輸入到(dào)TX-J小鼠(shǔ)肝髒,觀察到了小鼠血清轉氨酶降低,以及低比例的肝(gān)細胞ATP7B點突變被糾正(zhèng)(數據不展示(shì))。總之,基(jī)因治療的進展為WD患者帶來了希望,但基(jī)因治(zhì)療還處(chù)於基礎研究到臨床研究轉化的階段,還有很(hěn)多不(bú)成(chéng)熟的地方需(xū)要不斷完善和革(gé)新(xīn)。期望它將來能成為治療肝豆(dòu)狀核變性的一線療法。
參考文獻:
1.Wilson, S.A.K., Progressive lenticular degeneration. A familial nervous disease associated with cirrhosis of the liver. Lancet, 1912. 1: p. 1115-1119.
2.Gomes, A. and G.V. Dedoussis, Geographic distribution of ATP7B mutations in Wilson disease. Annals of Human Biology, 2016. 43(1): p. 1-8.
3.Rodriguez-Castro, K.I., F.J. Hevia-Urrutia, and G.C. Sturniolo,Wilson’s disease: A review of what we have learned. World journal of hepatology, 2015. 7(29): p. 2859.
4.Ariöz, C., Y.Z. Li, and P. Wittung-Stafshede, The six metal binding domains in human copper transporter, ATP7B: molecular biophysics and disease-causing mutations. Biometals, 2017. 30(6): p. 823-840.
5.Liver, E.A.F.T.S.O.T., EASL clinical practice guidelines: Wilson’s disease. Journal of hepatology, 2012. 56(3): p. 671-685.
6.Guggilla, S.R., et al., Spectrum of mutations in the ATP binding domain of ATP7B gene of Wilson Disease in a regional Indian cohort. Gene, 2015. 569(1): p. 83-87.
7.Hedera, P., Update on the clinical management of Wilson’s disease. The application of clinical genetics, 2017. 10: p. 9.
8.黃豔,劉誌峰, 肝豆狀核(hé)變性ATP7B基因突變的研究(jiū)進展.醫(yī)學綜述, 2019. 025(009): p. 1717-1721.
9.Harold and Rauch, Toxic milk, a new mutation affecting copper metabolism in the mouse. J Hered, 1983. 74(3): p. 141-144.
10.朱基彥, et al., 利(lì)用CRISPR/Cas9構建R778L類型肝豆狀核變性疾(jí)病小鼠模型.基礎醫學與臨(lín)床, 2018. 38(12): p. 6.
11.楊玉龍(lóng), et al., 肝豆狀核變性動物(wù)模(mó)型的研究進展(zhǎn).臨床肝(gān)膽病雜誌, 2022. 38(5): p. 6.
12.Fieten, H., et al., New canine models of copper toxicosis: diagnosis, treatment, and genetics. Human Disorders of Copper Metabolism I, 2014. 1314: p. 42-48.
13.Murillo, O., et al., Long-term metabolic correction of Wilson's disease in a murine model by gene therapy. Journal of Hepatology, 2016. 64(2): p. 419-426.
14.Liu, L.L., et al., Exon Replacement in the Mouse Gene by the Cas9 System. Human Gene Therapy, 2019. 30(9): p. 1079-1092.
15.Pöhler, M., et al., CRISPR/Cas9-mediated correction of mutated copper transporter ATP7B. Plos One, 2020. 15(9).


