
微生物控製的另一麵
眾所周知,實驗動物微生物(wù)質量控製是確(què)保研究數據準確有效的(de)基礎。經過一個多世(shì)紀的發展,科(kē)學家們很少再為人獸共患病(bìng)、引發實驗動物大量異常死亡的感染或其它健康問題而憂慮。許多實驗動物群體中甚至不攜帶大多數條件致病菌,以確保研(yán)究所用實驗動物的微生物狀(zhuàng)態不會成為混淆研究結果的因素。以科(kē)研中使用最多的實驗動物-小鼠為例,這在很大程度上得益於實(shí)驗小鼠供應商和使用單(dān)位都采用了屏障係(xì)統加獨立通風籠具構(gòu)成的隔離飼養體係和嚴格的消毒滅菌措施來控(kòng)製動物群(qún)體的整體健康狀況。然而,也正是這種做法,塑造了動物腸道菌群的有限多樣性以及在不同的動物設施之間動物腸道菌群種類和數量的巨大差異,而這種差異(yì)在多個維度上(shàng)影響了動物實驗的可重複性。
隨著16s rRNA測序分析(xī)、宏基因組測(cè)序分析等技術的應用,越來越多的研究證明常見的共生菌(jun1)會對動物模(mó)型產(chǎn)生顯著影響,不同動物群體(tǐ)間的嚴格隔離措(cuò)施(shī)也導致它們的微生(shēng)物組(zǔ)成的顯著差異,也(yě)進一步影響研究的可重複性(xìng)。一些廣泛存在於動物粘膜表麵的微(wēi)生物在特定的模型中被認為具有致病性或會加劇(jù)某(mǒu)些疾病的表型。例如,奇異變形杆菌被證明可以(yǐ)誘導小鼠多巴胺能神(shén)經元和運(yùn)動功能的損傷,從而對帕金(jīn)森病模型的表型展示產生嚴(yán)重影響(xiǎng)。類似的例(lì)子還有很多,其中被討論較多的共生菌對(duì)動物模型的影響見下表(biǎo):
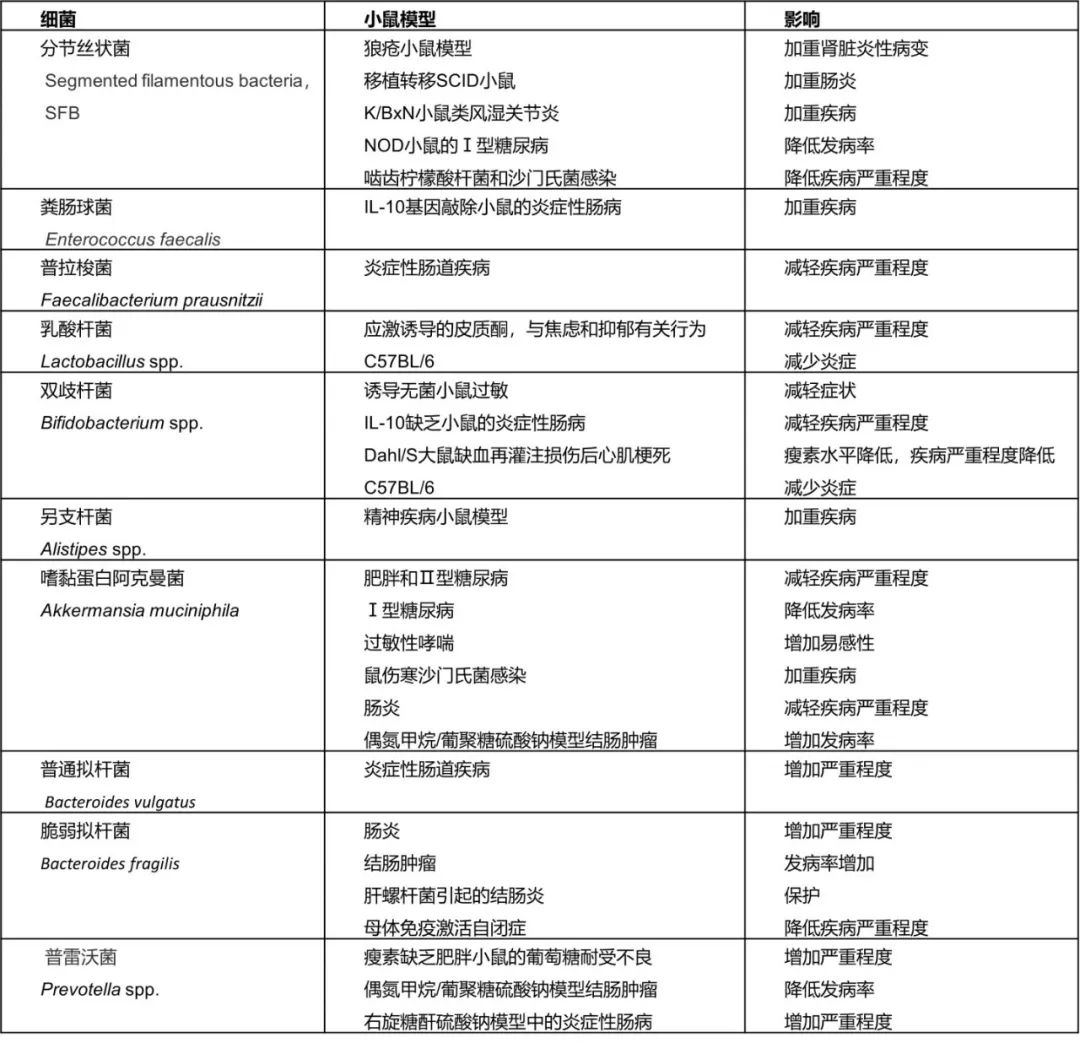
以上所述都是單一的細菌對動物模型的影響,但實際上動物體(tǐ)內所有的微生物組成(chéng)的整體(即微生(shēng)物組,Microbiome)和宿主的相互作用是十分複雜的。動物模型會受到體內(nèi)所有微生物的影響,特別(bié)是消化道菌群。胃腸道是種類繁多(duō)數量巨大的細菌、真菌、原生動物、古細菌、病毒的主(zhǔ)要定植地。這些微(wēi)生物與宿主形成相互作(zuò)用,進而影響宿(xiǔ)主的生理功能,並因此成了研(yán)究熱點。最近幾年使用分(fèn)子生物學技術進行的相關研究證明動物個體(tǐ)的微(wēi)生物(wù)組對其表型和疾病發生及進展有顯著影響。如白介素10基因(yīn)敲除小鼠是最常(cháng)用的結腸炎(yán)模型,但在不同實驗室,其結腸炎發展的嚴重(chóng)程(chéng)度不盡相同,腸道微生物的組成則是產生這些差異的主要因素。除此之(zhī)外,多篇報道還指出,化學誘導的結(jié)腸炎模型等多種其他小鼠結腸炎模型的(de)疾病嚴重程度也依賴腸道微生物組成。除了胃腸道研究領域外,動物的微生物組在神經(jīng)係統中也發揮著重要作用,不僅對(duì)焦(jiāo)慮和自閉(bì)症(zhèng)等模型的(de)表型產生(shēng)影響,也(yě)會影響實驗誘導的自身免疫(yì)性腦脊(jǐ)髓炎模型的表型。此(cǐ)外,微生物組還會影響腸道腫瘤(liú)的發(fā)生、糖尿病表型和肝(gān)髒疾病的(de)嚴重程度等。
如果要消除由(yóu)於微生物(wù)組差異導致的不良(liáng)影響,一個可能的(de)解決方案是實現實驗動物的腸道菌群的標準化(huà)。其中最早的標準菌群是由Russel W. Schaedler首先(xiān)建立的,由五種微生物(wù)組成的(de)“Schaedler菌群”,後由R.P. orcutt修改,產生了現在常用的由8種微生物組成的“Altered Schaedler Flora”(ASF)菌群,詳見本號(hào)前文《SPF小鼠是(shì)如(rú)何起源的》。然(rán)而這種人工構建的最小微生物群落並不能模擬天然微生物群落的複雜性。ASF定植的小鼠比常規定植的動物更類似於無菌小鼠,這表(biǎo)明這種小(xiǎo)的菌群可能導致疾病表型的喪失。目前也有研究(jiū)者在建立包括更多微生物的標準菌(jun1)群,其中包括“Oligo Mouse Microbiota 12”(OMM12)。該(gāi)菌群目前包含了小鼠腸道中12個主要細菌種類,其創(chuàng)建者也在改進其組成,以提高其複雜性和多樣性。此外,使用同窩動物或將動物共同飼養(yǎng)至少四周也可以提高不同組別動物的微生物(wù)組相似性,其中後者(zhě)被認為(wéi)是更簡單且有(yǒu)效的措施。
由(yóu)於SPF小鼠的微生物組(zǔ)多(duō)樣性缺失,對動物免疫功能產生了巨(jù)大影響,其中已經證實SPF小鼠缺(quē)乏某些記憶T細胞。有研究者(zhě)發現野生小鼠和寵物鼠則具有更(gèng)多樣化的菌群,其T細胞譜係也更類似成(chéng)年人類。這些小鼠的細胞免疫係統也處於更活躍的狀態,進而(ér)提高了宿主的適應性和抗病能(néng)力。而實(shí)驗小鼠在和這些動物(wù)共同飼養後也能(néng)提高微生物組的多樣性,並(bìng)可被誘導出和野生小鼠相似的(de)免疫細胞譜係。盡管這種(zhǒng)嚐試看起來(lái)比較極端,也會麵(miàn)臨潛在的致病性(xìng)病原體的(de)威脅,但不可(kě)否認這為提高實驗結果可靠性和可重複性(xìng)提供了可(kě)能的思路,也為我們更(gèng)好地理解微生物組對動物模型的影響提供了依據。
由於目前全球範圍內的動物設施都僅針對特定的病原體(tǐ)設置檢測列(liè)表(biǎo),而絕大多(duō)數科研人員顯然缺乏對所用動物微生物組成的了解。因此,將微生物組監測納入(rù)常規健(jiàn)康監測程(chéng)序可以幫助研究者們獲得更多信息,並(bìng)為應對更多動物健康和模型表型方麵的挑戰提供依據。但要(yào)實現這一(yī)目標需要更長期(qī)的探索,目前對(duì)微生物組的分析盡管已經有許多技術手段,但是依然存在諸多挑(tiāo)戰,尤其是在(zài)數據分析方麵。現階段更多是(shì)在特定(dìng)的(de)研究中將微生物組成的差異或某種(些)特定細菌的豐(fēng)度(dù)作為變量來考慮,並在此基礎上探究(jiū)它們對研究的影響。
正如一枚硬幣的兩(liǎng)麵(miàn),我們在確定微生物質量(liàng)控製的策(cè)略和(hé)製定動物微生(shēng)物質(zhì)量監測方案(àn)時需要同時考慮兩方麵(miàn)的影響,一方麵需要(yào)做(zuò)到保持標準化的實驗動物不攜帶人(rén)獸共患病、對動物健康有影響的病(bìng)原體以及某些(xiē)條件致病菌,另一方麵(miàn)也要考慮動物微生物(wù)組對研究數據的可重複性、可靠性的影響。
參考文獻:
1.Buchheister S, Bleich A. Health Monitoring of Laboratory Rodent Colonies-Talking about (R)evolution. Animals (Basel). 2021 May 14;11(5):1410.
2.Hansen, A.K.;Nielsen, D.S.,Krych,L.;Hansen,C.H.F. Bacterial species to be considered in quality assurance of mice and rats.Lab.Anim,2019,53,281-291.
3.Shi,Y;Mu,L. An expanding stage for commensal microbes in host immune regulation. Cell Mol. Immunol,2017,14,339-348


